-
Les combustions du méthane et du butane sont complètes si le dioxygène est en excès : il se forme alors de l'eau et du dioxyde de carbone.
-
Elles sont incomplètes s'il n'y a pas assez de dioxygène : il se forme alors aussi du carbone et/ou du monoxyde de carbone, un gaz incolore, inodore et très toxique.
Approfondir et voir des images ?

-
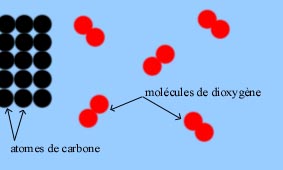
Le nombre d'atomes de chaque type ne varie pas au cours d'une transformation chimique, il faut donc ajuster l'équation de réaction, c'est-à-dire rajouter les coefficients nécessaires devant les formules chimiques.
- Au cours d'une transformation chimique, la masse globale se conserve car le nombre d'atomes ne change pas !